1. DAļA
1. uzdevums.
Vai apgalvojums ir pareizs? Apvelciet pareizo atbildi ar aplīti!
|
1. Slāpeklis ir bezkrasaina gāze ar asu smaku. |
Jā | Nē |
|
2.. Normālos apstākļos etiķskābe ir šķidra viela. |
Jā | Nē |
|
3. Ja eļļu sajauc ar ūdeni, veidojas emulsija. |
Jā | Nē |
|
4. Benzpirēni ir vielas ar kancerogenu iedarbību, kuri sastopami automobiļu atgāzēs, ceptos un kūpinātos pārtikas produktos. |
Jā | Nē |
|
5. Korozijas inhibitori paātrina tērauda rūsēšanu. |
Jā | Nē |
|
6. Esterus izmanto par škīdinātājiem. |
Jā | Nē |
|
7. Alumīnija sulfātu izmanto dzeramā ūdens dezinficēšanai. |
Jā | Nē |
|
8. Latvijā ražo polietilēna izstrādājumus. |
Jā | Nē |
|
9. Ziepes labi puto cietā ūdenī. |
Jā | Nē |
|
10. Svina, kadmija, dzīvsudraba u. c. smago metālu jonu iedarbībā olbaltumvielas zaudē savu raksturīgo uzbūvi un īpašības. |
Jā | Nē |
2. uzdevums.
Katram jautājumam ir tikai viena pareiza atbilde. Izvēlēties pareizo atbildi un apvelciet tās burtu ar aplīti! Nepieciešamajām darbībām izmantojiet lapas brīvās vietas !
1. Cik protonu ir dzīvsudraba atoma kodolā?
|
A 201 |
B 80 |
C 121 |
D 47 |
2. Kurā no kodolreakcijām veidojas a - daļiņa?
A 238U --> 234Th + ...
B 234Pa --> 234U + ...
C 8B --> 8Be + ...
D 6He --> 6Li + ...
3. Cik elektronu ir dzelzs atoma ārējā enerģijas līmenī?
|
A 2 |
B 4 |
C 6 |
D 8 |
4. Kurā vielā ir ūdeņraža saite?
|
A H2 |
B H2O2 |
C C2H2 |
D NaH |
5. Kura shēma attēlo kālija hlorīda kristālrežģa uzbūvi?

6. Kuras vielas ūdensšķīdums praktiski nevada elektrisko strāvu?
|
A HCOOH |
B CsBr |
C C2H5OH |
D NH3 |
7. Kura viela izdalās pie anoda, elektrolizējot vara(II) sulfāta ūdensšķīdumu?
|
A Cu |
B H2 |
C O2 |
D S |
8. Kura sāls ūdens šķīdumā metiloranžs kļūst sarkans?
|
A AgNO3 |
B NaHCO3 |
C CH3COOK |
D Na2CrO4 |
9. Kuru gāzveida vielu nav iespējams uzkrāt traukā, izspiežot no tā ūdeni?
|
A CH4 |
B H2 |
C O2 |
D HCl |
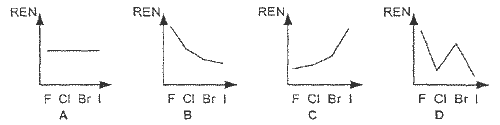
10. Kurš grafiks attēlo halogēnu relatīvās elektronegativitātes (REN) maiņu?
11. Cik liels atomu skaits ir 2,0 molos ūdens?
|
A 6 |
B 6,02�1023 |
C 12,04 � 1023 |
D 36,12 � 1023 |
12. Pārvērtībā CaCO3(c.)<==> CaO(c.) + CO2(g.)- Q
ķīmiskais līdzsvars pārvietojas kalcīja oksīda rašanās virzienā, ja
|
A paaugstina spiedienu |
B paaugstina temperatūru |
|
C pazemina temperatūru |
D izmanto katalizatoru |
13. Cik liels gaisa tilpums litros tiek patērēts, sadedzinot 2 l etēna (n. a.)?
|
A 3 |
B 30 |
C 6 |
D 60 |
14. Cik liela ir koeficientu summa oksidēšanās - reducēšanās reakcijā:
__ KMnO4 + __ HCl --> __ Cl2 + __ MnCl2 + __ KCl + __ H2O?
|
A 40 |
B 35 |
C 30 |
D 25 |
15. Uz sadzīves ķīmisko līdzekļu iepakojuma ir dažādas brīdinājuma zīmes. Kurš no redzamajiem sadzīves ķīmiskajiem līdzekļiem ir kodīgs?

3. uzdevums.
Tabulā doti dažādu organisko savienojumu klašu nosaukumi.
|
Organisko savienojumu klases nosaukums |
Burts |
|
|
1. |
Alkani |
|
|
2. |
Alkēni |
|
|
3. |
Alkīni |
|
|
4. |
Spirti |
|
|
5. |
Fenoli |
|
|
6. |
Aldehīdi |
|
|
7. |
Karbonskābes |
|
|
8. |
Aminoskābes |
|
|
9. |
Esteri |
|
|
10. |
Halogēnogļūdeņraži |
Kurš no savienojumiem pieder attiecīgajai organisko savienojumu klasei? Ierakstiet tabulā pareizās atbildes burtu! (Uzmanību: formulu piemēru ir vairāk nekā organisko savienojumu klašu!)
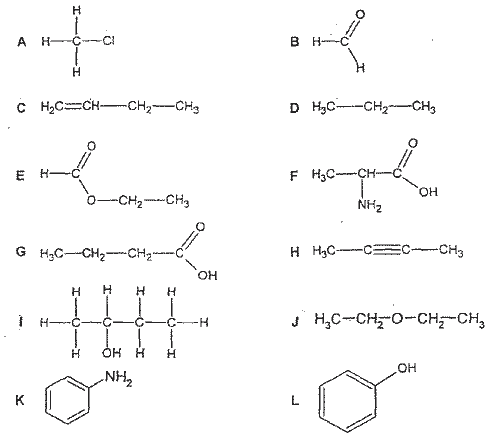
Pēc darba vadītāja norādījuma ierakstiet vai atzīmējiet izvēlētās atbildes atbilzu lapā!
Darbu var turpināt tikai pēc darba vadītāja norādījumiem!
1. uzdevums. (5 punkti)
Pabeidziet dotos reakciju vienādojumus!
Mg + O2->
K + H2O ->
AlCl3 + NaOH ->
P2O5 + H2O ->
C3H6 + O2->
2 uzdevums. (5punkti)
Sastādiet ķīmisko reakciju vienādojumus:
nātrija karbonāts + kalcija hlorīds
___________________________________________________
magnija hidroksīds + slāpekļskābe
___________________________________________________
bārija oksīds + hlorūdieņražskābe
___________________________________________________
fenols + nātrija hidroksīds
___________________________________________________
etēns + broms
___________________________________________________
3. uzdevums. (5.punkti)
Uzrakstiet 5 reakciju vienādojumus iespējamām ķīmiskajām reakcijām starp dotajām vielām!
|
Vielas |
O2 |
Na |
NaOH |
HCl |
NaHCO3 |
|
C2H5Cl |
1. | 2. | 3. | 4. | 5. |
|
C2H5OH |
6. | 7. | 8. | 9. | 10. |
|
CH3COOH |
11. | 12. | 13. | 14. | 15. |
 |
16. | 17. | 18. | 19. | 20. |
1.___________________________________
2.___________________________________
3.___________________________________
4.___________________________________
5.___________________________________
4. uzdevums. (5 punkti)
Uzrakstiet reakcijas vienādojumus pārvērtībām!
Kālija hidroksīds 1. >kālija hidrogēnsulfāts 2. > kālija sulfāts 3. > kālija hlorīds 4. > hlors 5. > dzelzs(lll) hlorīds
1.___________________________________
2.___________________________________
3.___________________________________
4.___________________________________
5.___________________________________
5. uzdevums. (9 punkti)
Aprēķiniet:
a) cik liela ir kalcija karbonāta masa 280,0 g kaļķakmeņa, kas satur 10,0% piemaisījumu;
b) cik liels kalcija karbonāta daudzums ir 20,0 gramos šīs vielas;
c) cik liels slāpekļskābes daudzums tiek patērēts reakcijā ar 0,4 moliem kalcija karbonāta;
d) cik liels tilpums oglekļa(lV) oksīda (n. a.) izdalās, 0,1 molam slāpekļskābes reaģējot ar kalcija karbonāta pārākumu;
e) cik liela masa ir 112 litriem (n. a.) oglekļa(lV) oksīda!
6. uzdevums. (10 punkti)
Vielas molekulformula ir C2H6O.
1. Aprēķiniet elementu masas daļas (%) vielai
2. Aprēķiniet vielas tvaiku relatīvo blīvumu pret ūdeņradi!
3. Sastādiet vielas divu izomēru struktūrformulas un uzrakstiet to nosaukumus!
7. uzdevums. (6 punkti).
Salēja 400 ml 0,2 M kālija hidroksīda šķīduma ar 600 ml 0,1 M etānskābes šķīduma.
1. Uzrakstiet kālija hidroksīda un etānskābes savstarpējās iedarbības reakcijas vienādojumu!
2. Aprēķiniet reakcijas rezultātā iegūtā sāls masu!
3. Pamatojiet, kura no vielām pilnībā neizreaģēja!
8. uzdevums. (20 punkti).
Attēlā redzama Sēra(IV) oksīda iegūšanas iekārta.
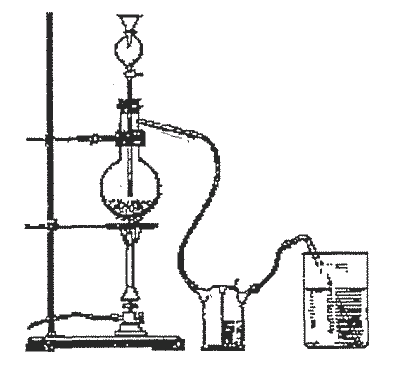
Virca kolbā iebērtas vara skaidiņas, pilināmajā piltuvē ielieta koncentrēta sērskābe, skalotnē ielieta koncentrēta sērskābe, bet vārglāzes ar dažādu vielu šķīdumiem tiek mainītas, lai pētītu sēra(IV) oksīda ķīmiskās īpašības.
1. Uzrakstiet sēra(lV) oksīda iegūšanas molekulāro vienādojumu un oksidēšanās-reducēšanās reakcijas vienādojumu!
2. Paskaidrojiet, kāpēc skalotnē ir ielieta koncentrēta sērskābe!
Lai pētītu sēra(lV) oksīda ķīmiskās īpašības, vārglāzēs ielēja bromūdeni, sērūdeņraža ūdens šķīdumu un bārija hidroksīda šķīdumu.
Pēc sēra(!V) oksīda ievadīšanas 1. vārglāzē radās baltas nogulsnes, 2. vārglāzē dzeltenīgais šķīdums atkrāsojās, bet 3. vārglāzē šķīdums saduļķojās.
3. Uzrakstiet vielu nosaukumus, kuras atradās katrā no vārglāzēm!
1. vārglāzē bija ________________________
2. vārglāzē bija_________________________
3. vārglāzē bija_________________________
4. Ar molekulārajiem, jonu un oksidēšanās - reducēšanās reakcijas vienādojumiem palīdzību aprakstiet 1., 2. un 3. vārglāzē notikušās pārvērtības!
1. vārglāzē
2. vārglāzē
3. vārglāzē
5. Miniet vienu ķīmiskās rūpniecības nozari, kurā ražošanas procesa ir iespējama sēra(IV) oksīda noplūde gaisā!
6. Sastādiet pārvērtību rindu, kas attēlo sēra(IV) oksīda pārvērtības gaisā, kuru rezultātā veidojas "skābais lietus"!
7. Kāpēc marmora skulptūras bojājas "skābo nokrišņu" ietekmē? Atbildi pamatojiet ar reakcijas vienādojumu!